Las ranas: de la medicina tradicional a nuevos fármacos
Yvonne Rosenstein y Constance Auvynet
Naturaleza y medicina, una larga historia...
Durante más de seis mil años, la humanidad ha probado y seleccionado sustancias naturales de plantas, animales y microorganismos con fines curativos, pero también rituales, cosméticos o domésticos. Una de las primeras referencias al uso de sustancias naturales se remonta al antiguo Egipto, durante el segundo milenio antes de nuestra era; por ejemplo, los papiros médicos conservados desde entonces mencionan remedios con sangre de lagarto o excremento de cocodrilo contra las enfermedades oculares que eran comunes en esa civilización.
Si bien las sustancias de origen vegetal o animal se han utilizado durante siglos para combatir enfermedades, la base científica de los mecanismos a través de los cuales funcionan estos remedios no comenzó a investigarse formalmente sino hasta el siglo XVIII. Así, la aspirina, antipirética (contra la fiebre), analgésica (dolores) y antiinflamatoria, utilizada ahora en todo el mundo, era un elemento clave de la medicina tradicional antigua: desde el año 500 A.C., Hipócrates recomendaba el té de hierbas de hojas de sauce blanco (Salix spp.) para aliviar el dolor y la fiebre. Pero fue hasta 1829 que el principio activo contenido en las hojas de este árbol, la salicina, fue aislado por P.J. Leroux [1].
Hoy día, aunque la mayoría de las drogas terapéuticas se pueden obtener por procesos de síntesis química partiendo de sus precursores, más del 40% son de origen natural, y de éstas el 75% son de origen vegetal; el 15% de origen microbiano y el 10% de origen animal [2]. No obstante, la aparición de diversos agentes infecciosos (dengue, Zika; SARS-CoV-2, viruela del mono, etc.), aunado a los fenómenos de resistencia a antibióticos, la toxicidad o la pérdida de la efectividad de ciertos fármacos, obligan a investigador@s en disciplinas farmacéuticas y clínicas, a buscar y probar nuevas sustancias para hacer frente a estos graves problemas de salud.
Las ranas: fuente de ritos, creencias y remedios a lo largo de los siglos
Los anfibios (ανφι-anfi= ambos; βιοs-bios= vida), son los únicos vertebrados cuyo desarrollo va acompañado de una metamorfosis radical que los transforma de una forma acuática basada en branquias, a una forma anfibia dotada de un sistema respiratorio aéreo (pulmones). Con más de 5 mil especies, los anfibios —ranas y sapos, salamandras y cecílidos— son uno de los grupos más diversos de vertebrados terrestres y acuáticos. Las ranas de la familia Ranidae presentes en los continentes norteamericano, europeo y asiático, así como las ranas arborícolas de la familia Hylidae de Australia, África y el subcontinente latinoamericano, son las más conocidas y estudiadas. En México en particular, la diversidad de la fauna es muy notable en anfibios, con varias especies endémicas; es decir que solo se localizan y posiblemente, se originaron en nuestro territorio.
Por varias de estas características, las ranas han ejercido fascinación y ocupado un lugar privilegiado en la vida cotidiana de diversas civilizaciones del mundo y durante siglos, los también llamados batracios han sido indudablemente un grupo de animales estrechamente asociado con la brujería, la religión, los ritos y las creencias esotéricas. No obstante, en las diversas culturas, las ranas han sido un símbolo de fertilidad y renovación. En la civilización mexica, Tlaltecuhtli (o también Tlalcíhuatl), como parte de sus atributos como diosa de la tierra, era una deidad de la fertilidad y la lluvia representada por la rana [Fig.1].

Figura 1.
Más allá de diversos ritos y creencias, los productos obtenidos de las ranas se han usado en la medicina tradicional por su reconocida capacidad de facilitar la cicatrización de heridas. La referencia más antigua se remonta a los asirios (2,000-1,000 a.C.), con el descubrimiento de tablillas de escritura cuneiforme que relatan el uso de extractos de bilis de rana mezclados con leche para curar las infecciones de los ojos [3]. México no es la excepción ya que, desde la época prehispánica, está documentado el uso de las ranas en la medicina tradicional, la que todavía permanece hasta hoy en día. Por ejemplo, algunas comunidades indígenas del estado de México usan todavía secreciones de la rana Tláloc (Lithobates tlaloci), endémica de la cuenca de México, como remedio para la diabetes o la tos [4].
Otro ejemplo es el de comunidades indígenas del Amazonas occidental que utilizan la secreción de la piel de la rana Phyllomedusa bicolor como una poción para aumentar la fuerza muscular, la agudeza visual y la resistencia a la fatiga antes de cazar. La secreción seca se aplica a heridas auto-inflingidas [Fig. 2] y la respuesta, fisiológicamente muy violenta primero, provoca un profundo malestar seguido de un período de indolencia, para finalmente conducir al estado esperado; un escritor estadounidense quien experimentó los efectos de esta poción relata: “Cuando te despiertas… te sientes como un dios” [5]. Esta costumbre se ha trasladado a México y tal secreción de la rana, llamada ‘el kambo’ se aplica para limpiar el cuerpo de toxinas.

Figura 2.
Los primeros descubrimientos y el concepto del triángulo piel-cerebro-intestino
El uso recurrente de secreciones de piel de rana en la medicina tradicional hizo sospechar que contenían moléculas potencialmente interesantes desde el punto de vista farmacológico. Sin embargo, no fue hasta la primera mitad del siglo XX que las primeras sustancias activas de las secreciones cutáneas de anfibios fueron aisladas y caracterizadas por Erspamer y cols., quienes descubrieron un grupo de aminas biogénicas como la enteramina (antidiurético) [6], así como los primeros péptidos biológicamente activos, como la fisaleimina, (hipotensor) [7] [fig. 3]. Además, se han aislado otras sustancias no-peptídicas de naturaleza alcaloide denominadas pumiliotoxina, batracotoxina, histrionicotoxina, bufodienolidas o bufogeninas (que incluye bufotoxinas, bufotalinas y cardenolidas). Los análisis también detectaron otros compuestos conocidos (serotonina, histamina, adrenalina o dopamina), en su mayoría derivadas de secreciones cutáneas altamente tóxicas [8].
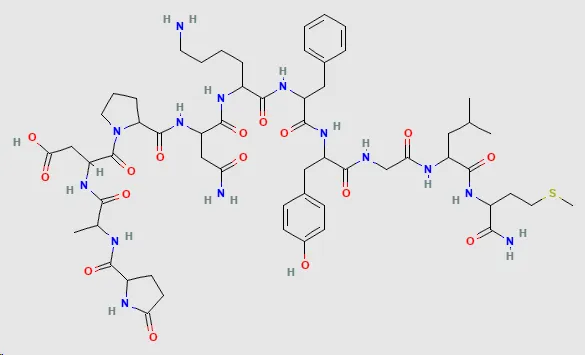
Figura 3.
Estos primeros descubrimientos dieron pie a otros estudios sobre el fabuloso potencial farmacológico de la piel de ranas. Hoy en día, se han aislado más de cuatrocientos péptidos con actividades biológicas muy diversas como neuromediadores, vasodilatadores, hormonas, factores de crecimiento, opioides, inmunomoduladores y sobre todo, péptidos antimicrobianos. De forma muy llamativa estos péptidos descubiertos revelaron similitudes con hormonas y neuropéptidos aislados en mamíferos; es decir, resultó por ejemplo que la estructura y la actividad biológica de la fisalamina de ranas eran homólogas a las de un péptido bioactivo nombrado “sustancia P”, que fue purificado 50 años antes a partir de extractos de cerebro e intestino de caballo [9]. Más aún, estos descubrimientos permitieron a Erspamer proponer un concepto conocido como el “triángulo piel-cerebro-intestino" el cual sugiere que cualquier péptido que se encuentre en alguno de estos tres compartimentos orgánicos —la piel de los anfibios, el cerebro o el tracto gastrointestinal de los mamíferos— también debiera estar presente en los otros dos compartimentos, en forma de un péptido cuya estructura bioquímica fuera parecida o idéntica [10]. Siguiendo un enfoque fisiológico y evolutivo, después se logró encontrar tales moléculas en cerebro e intestinos de anfibios, así como otras correspondencias entre los productos de la piel de los anfibios y los del cerebro e intestinos de los mamíferos.
Las secreciones de ranas: una fuente singular y en cantidades extraordinarias
Las sustancias activas de las ranas son producidas por glándulas séricas de la piel; estas sustancias presentan la ventaja de poder recolectarlas por estímulo eléctrico o por simple presión de la piel; esto se puede repetir cada quince días, sin necesidad de sacrificar al animal para obtener una fuente abundante de péptidos. A diferencia de los mamíferos donde los péptidos están presentes en cantidades mínimas, aquellos en la piel de los anfibios, generalmente se producen en grandes cantidades, de modo que es posible aislar material suficiente para obtener la secuencia de aminoácidos y también, ensayar sus efectos farmacológicos a partir de un solo espécimen.
Comparativamente, la abundancia de estos péptidos es tal que se necesitaban 270 mil hipotálamos de ovejas para obtener sólo 1 mg de la hormona tirotropina, mientras que la piel de una rana africana con uñas del género Xenopus, contiene hasta 15 μg por gramo de piel [11]. De igual manera, el exudado de la mencionada P. bicolor contiene 400 μg de una biomolécula llamada ‘Péptido del Gen Relacionado a la Calcitonina [de la piel]’ (abreviado S-CGRP en inglés), que es 500 veces más que lo que se obtiene de una sola médula espinal humana, que contiene altas concentraciones del CGRP [12]. Y bien, aunque son similares a los péptidos de mamíferos en la gran mayoría de los casos, los péptidos de anfibios exhiben frecuentemente propiedades estructurales y/o actividades biológicas mejoradas: el ejemplo más llamativo es el de la familia de las dermorfinas, unos analgésicos cuya potencia farmacológica es notable, ya que es mil veces superior a la de la morfina y produce efectos catalépticos [Fig. 4] [13].

Figura 4.
¿Son los péptidos de rana una fuente prometedora de nuevas moléculas terapéuticas?
La investigación realizada con secreciones de piel de ranas ha hecho visible la vasta diversidad de péptidos cuyas propiedades biológicas originales —algunas desconocidas en los mamíferos— son de gran interés farmacológico y terapéutico. Actualmente existe una necesidad real de desarrollar nuevos tratamientos seguros, efectivos y accesibles para combatir enfermedades inflamatorias e infecciosas. En particular, los tratamientos antinflamatorios disponibles, inhiben las funciones protectoras del sistema inmunológico de manera inespecífica y por lo tanto, facilitan las infecciones oportunistas además de otros efectos no deseados. En consecuencia, nuestro grupo de investigación en el IBt-UNAM se ha enfocado en la búsqueda y caracterización de péptidos bifuncionales en secreciones cutáneas de la rana Pachymedusa dacnicolor [Fig. 5] que controlen la inflamación, sin comprometer totalmente la capacidad del cuerpo a combatir las infecciones.

Figura 5.
Referencias
El presente artículo contiene elementos del seminario presentado en el Simposio de Verano del IBt en 2022 (disponible en https://bit.ly/IBt-SV22-d1 [t=1:35/ 2:08], y en otras publicaciones del grupo.
1. Lafont O (2007). Du saule à l'aspirine. Revue d'histoire de la pharmacie, 94e année, n° 354, pp. 209-216
2. Samuelsson G & L Bohlin (2015). Drugs of natural origin: A treatise of pharmacognosy, 7th ed. Swedish Pharamceutical Press. ISBN 978-91980-94251 || Nicolaou KC (2014). Organic synthesis: the art and science of replicating the molecules of living nature and creating others like them in the laboratory. Proc Math Phys Eng Sci 470(2163): 20130690. DOI: 10.1098/rspa.2013.0690
3. Lévêque P (1999). Les grenouilles dans l’antiquité: Cultes et mythes des grenouilles en Grèce et ailleurs. Paris: Editions de Fallois. ISBN 270-283-587-6
4. Guerrero Ortiz, S. y OG Retana Guiascón (2012). Uso medicinal de la fauna silvestre por indígenas Tlahuicas en Ocuilan, México, Etnobiología, 10 (2): 28-33
5. Amato (1992) From hunter magic, a pharmacopeia? Science. 20;258(5086):1306
6. Erspamer V. & M Vialli (1951). Enteramine in amphibian skin. Nature 167: 1033-103
7. Erspamer V, G Bertaccini, & JM Cei (1962). Occurence of an eledoisin-like polypeptide (physalaemin) in skin extracts of Physalaemus fuscumalatus. Experientia 18: 562-563
8. Lazarus LH, M Attila (1993). The toad, ugly and venomous, wears yet a precious jewel in his skin. Prog Neurobiol. 41(4): 473-507
9. Chang .M, SE Leeman & HD Niall (1971) Amino-acid sequence of substance P. Nat. New. Biol. 232: 86-87
10. Erspamer V, Melchiorri P, Broccardo M et al. (1981). The brain-gut-skin triangle: new peptides. Peptides 2 (Suppl 2): 7-16
11. Bennet GW, CA Marsden, RM Clothier et al. (1982). Co-existence of thyrotrophin releasing hormone and 5-hydroxytryptamine in the skin of Xenopus laevis. Comp Biochem Physiol C 72: 257-261
12. Seon AA, TN Pierre, V Redeker, et al. (2000) Isolation, structure, synthesis, and activity of a new member of the calcitonin gene-related peptide family from frog skin and molecular cloning of its precursor J Biol Chem 275(8): 5934-5940
13. Mor A, A Delfour, S Sagan, M Amiche et al. (1989). Isolation of dermenkephalin from amphibian skin, a high-affinity delta-selective opioid heptapeptide containing a D-amino acid residue. FEBS Lett 255: 269-74
Comparte este artículo en redes sociales

Acerca de los autores
Contacto: yvonne.rosenstein@ibt.unam.mx; constance.auvynet@ibt.unam.mx






