Ingeniería de vías metabólicas: rediseñando bacterias para convertirlas en biofábricas productoras de compuestos de interés
Rubén Mendoza Flores, Francisco Bolívar y Adelfo Escalante
Los microorganismos como biofábricas
Utilizando las técnicas de la biotecnología moderna es posible modificar los flujos del metabolismo de los microbios y transformarlos en 'biofábricas' productoras de compuestos químicos diversos, para la síntesis directa o indirecta de fármacos, polímeros y biocombustibles [Fig. 1].
Este tipo se aplicaciones forma parte de la llamada "Ingeniería de vías metabólicas" (IVM), derivada de varias áreas del conocimiento (microbiología, bioquímica, genética) la cual se ha perfilado como una de las tecnologías emergentes con mayor potencial de sustentabilidad [1].
Al igual que nuestro organismo, muchos microbios transforman los nutrientes presentes en su medio ambiente en energía y en componentes estructurales de sus células, mediante variadísimas reacciones bioquímicas secuenciales, alternativas y localizadas llamadas vías (o rutas) metabólicas. Muchos compuestos intermediarios y productos metabólicos terminales poseen interés industrial, médico o agrícola; sin embargo, naturalmente son producidos en cantidades extremadamente bajas para ser aprovechados de forma masiva.
De las ciencias bioquímicas sabemos que las vías metabólicas están impulsadas, interconectadas y reguladas por proteínas con actividad catalítica que llamamos enzimas, —a veces muy distintas y otras veces con similitudes sugestivas— y cuyos nombres están relacionados con el tipo de compuesto que utilizan como sustrato o al producto de la reacción (aunque muchas son reversibles); algunas pueden actuar en una o varias vías metabólicas. Como todas las enzimas derivan de información genética en donde están codificadas, mediante técnicas de modificación genética y de cultivo experimental, podemos controlar la 'expresión' (síntesis, concentración, actividad) de las enzimas, así como de otros mecanismos de regulación, para restructurar los flujos metabólicos de los microorganismos de interés y así mejorar sus capacidades de producción. Partiendo de pruebas de concepto exitosas, podemos escalar posteriormente el proceso y cultivarlos en grandes tanques llamados biorreactores para fabricar, biotecnológicamente, los compuestos de interés en cantidades aprovechables.
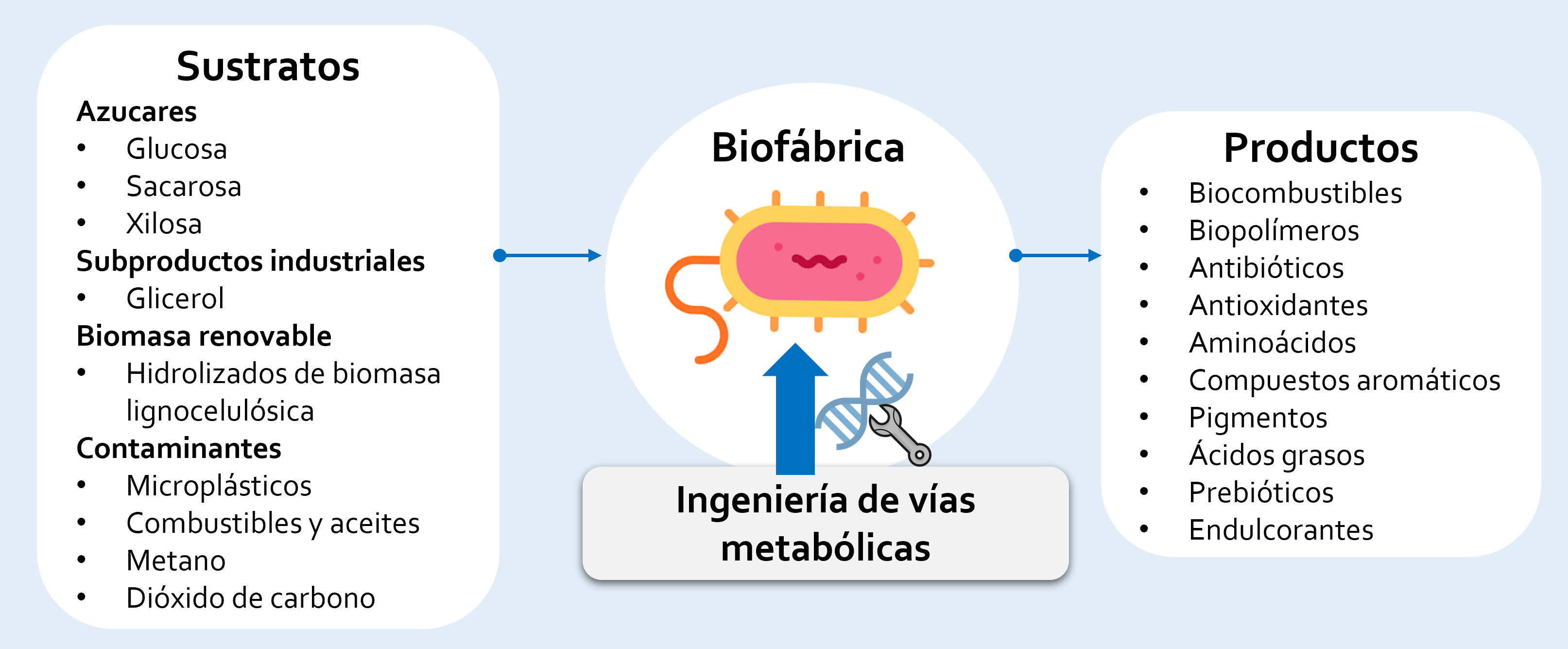
Figura 1. La ingeniería de vías metabólica permite modificar el metabolismo de diversas bacterias y levaduras y utilizarlas como biofábricas para transformar varios sustratos (Izq.), y obtener cantidades o proporciones significativas de productos relevantes (Der.).
Pasos y consideraciones para desarrollar una biofábrica
La estrategia para el desarrollo de las biofábricas mediante IVM (que parece muy directa), puede demandar de cientos de personas, gran cantidad de tiempo (6 a 8 años) y la inversión de recursos económicos importantes (hasta 50 millones de dólares) [2].
La producción de algunos compuestos particulares (ácidos orgánicos, antibióticos, precursores de bioplásticos, gomas, etc.), requiere de procedimientos iterativos y retroalimentados; es decir, se van realizando modificaciones genéticas en cepas, variantes o mutantes de los microorganismos, mediante experimentos paralelos, para ir evaluando los cambios fisiológicos (consumo de nutrientes, crecimiento, diferenciación) y, asimismo su capacidad (gradual y final) de producción.
El proceso es repetido y optimizado hasta alcanzar los niveles de producción y recuperación deseados [Fig. 2]. En resumen, para evaluar el desempeño de una biofábrica son importantes tres parámetros que considerar: el título (P) expresado como gramos o moles —como medida de concentración molecular en soluciones acuosas— de producto por litro; el rendimiento (Y) que es a la cantidad de producto obtenido por cada gramo o mol del sustrato, y la productividad (q) se refiere a la 'rapidez' con la que se produce el metabolito en una hora en un litro del cultivo. Con respecto al escalamiento, se toma en cuenta que los microorganismos deben más adelante, 'resistir' las condiciones industriales de fermentación (tipo de mezclado, variaciones de temperatura, pH y presión de gases, presencia de compuestos tóxicos), capacidades para los que también se recurre a mejoras por ingeniería genética. Actualmente, los modelos microbianos más utilizados industrialmente son diversas cepas de Escherichia coli, Bacillus subtilis, Corynebacterium glutamicum (bacterias) y Saccharomyces cerevisiae (levadura), que cumplen estas características.
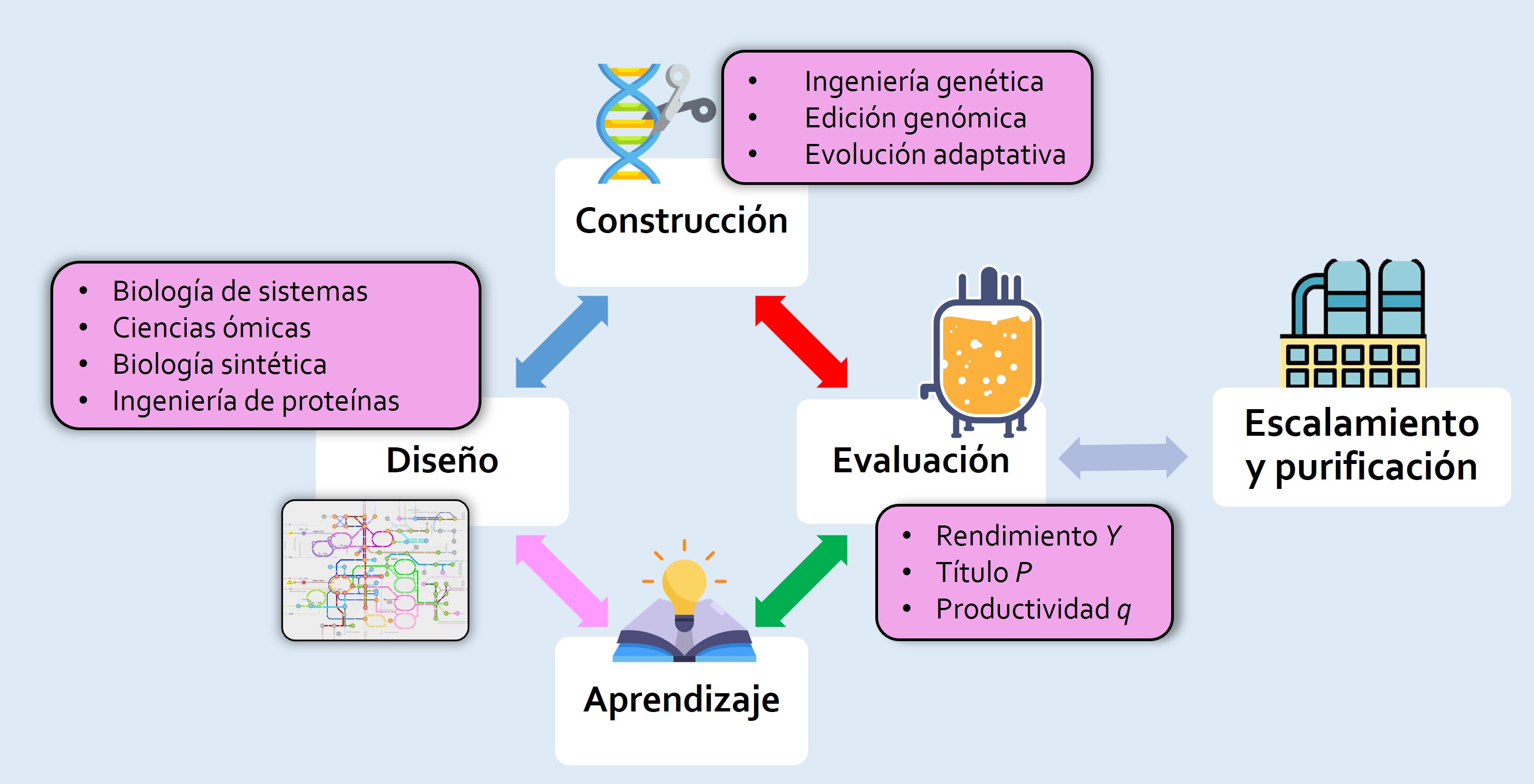
Figura 2. La Ingeniería de Vías Metabólicas (IVM) es un ciclo de investigación experimental e innovación tecnológica, realizado de forma colectiva, con retroalimentación e iterativo, que se desarrolla hasta alcanzar las capacidades de producción deseadas. Esto permite entre otras cosas, la realización de tesis de grado/ posgrado, la publicación de artículos científicos y/o solicitudes para la protección de derechos de propiedad intelectual.
Por el lado de la viabilidad económica es importante que los sustratos a usar —que son fuente de los elementos o compuestos básicos— deben ser baratos, seguros y accesibles; por ejemplo: glucosa y otros azúcares comunes, subproductos industriales como el glicerol y la biomasa renovable (ver Biotecmov Núm. 27 y Art#5 en este número). En términos generales, la IVM se ha ido complementando con otras disciplinas como la ingeniería de proteínas, bioinformática y técnicas de edición genómica (como CRISPR-Cas), que a su vez se nutren del enfoque de las ómicas (genómica, transcriptómica, metabolómica y fluxómica y otras más), que han permitido analizar y modificar al metabolismo celular de una forma integral. Se parte también de que estos procesos (síntesis, degradación y los distintos niveles de regulación genética y metabólica) son considerados un sistema complejo que puede ser modelado matemáticamente, para plantear estrategias de modificación genética o de cultivo [Fig. 2].
El caso de la producción del ácido shikímico
El ácido shikímico (SHK), es un intermediario de la vía de síntesis de los compuestos aromáticos (que contienen grupos fenilos, bencilos, indoles y otros). Su producción como intermediario ha ganado interés científico e industrial en las últimas décadas ya que sus grupos reactivos lo convierten en un compuesto muy versátil, haciendo de esta molécula un excelente precursor de nuevos compuestos bioactivos. Tal es el caso del fármaco Oseltamivir, el compuesto anti-influenza más utilizado actualmente y comercializado por la empresa Hoffmann-La Roche como Tamiflu®) [3]. La empresa obtiene el SHK por extracción de la "planta anís estrella chino" y también, a partir de cepas propietarias de E. coli desarrolladas por IVM; sin embargo, su capacidad de producción es limitada y puede ser insuficiente ante un posible escenario viral pandémico —como lo hemos visto— por lo que los investigadores alrededor del mundo se encuentran desarrollando nuevas estrategias para su producción por IVM [3].
Conceptos de evolución útiles para el desarrollo de la IVM
En nuestro grupo de investigación del IBt, dirigido por los Dres. Francisco Bolívar y Adelfo Escalante y en parte de mi proyecto de posgrado, se han desarrollado cepas de E. coli productoras de compuestos aromáticos, de entre las que destaca una cepa sobreproductora de SHK denominada AR36. La historia, va más o menos así: para consumir glucosa (Glu), fuente de carbono que será transformada a SHK por una vía fermentativa, E. coli usa como 'entrada' a un complejo de proteínas transportadoras de la glucosa o 'sistema de fosfotransferasa' (PTS) anclado en la membrana; este sistema utiliza normalmente una de las dos moléculas de fosfo·enol·piruvato (PEP) que resultan de la degradación de cada molécula de Glu más adelante de la vía. El sistema PTS específico para glucosa es el más importante transportador de este azúcar en E. coli. Para la síntesis del SHK también se requiere una molécula de PEP, por lo que la posibilidad de que la bacteria pueda usar las dos moléculas de PEP para incrementar la síntesis de SHK, ha impulsado a diferentes grupos de investigación en el mundo (incluyendo el nuestro) a 'evitar' el sistema de PTS como entrada específica para glucosa [Fig. 3].
Bajo condiciones de cultivo, las bacterias son capaces de duplicarse rápidamente (en horas) y por tanto pueden sufrir mutaciones (al azar) que permiten someterlas a una 'presión de selección' dentro de biorreactores experimentales y obtener cepas 'evolucionadas' ---con las características buscadas--- en tiempos relativamente cortos. Este es el proceso que denominamos 'Evolución Adaptativa en Laboratorio' (ALE, por sus siglas en inglés; ver adelante). De acuerdo con esta estrategia y para obtener una cepa que pueda utilizar teóricamente dos moléculas de PEP a para la síntesis de SHK, se realizó un procedimiento que inactivó el PTS de una cepa silvestre de E. coli. Este bloqueo al principal sistema de transporte de glucosa, resultó en una disminución de hasta el 75% en su tasa de crecimiento.
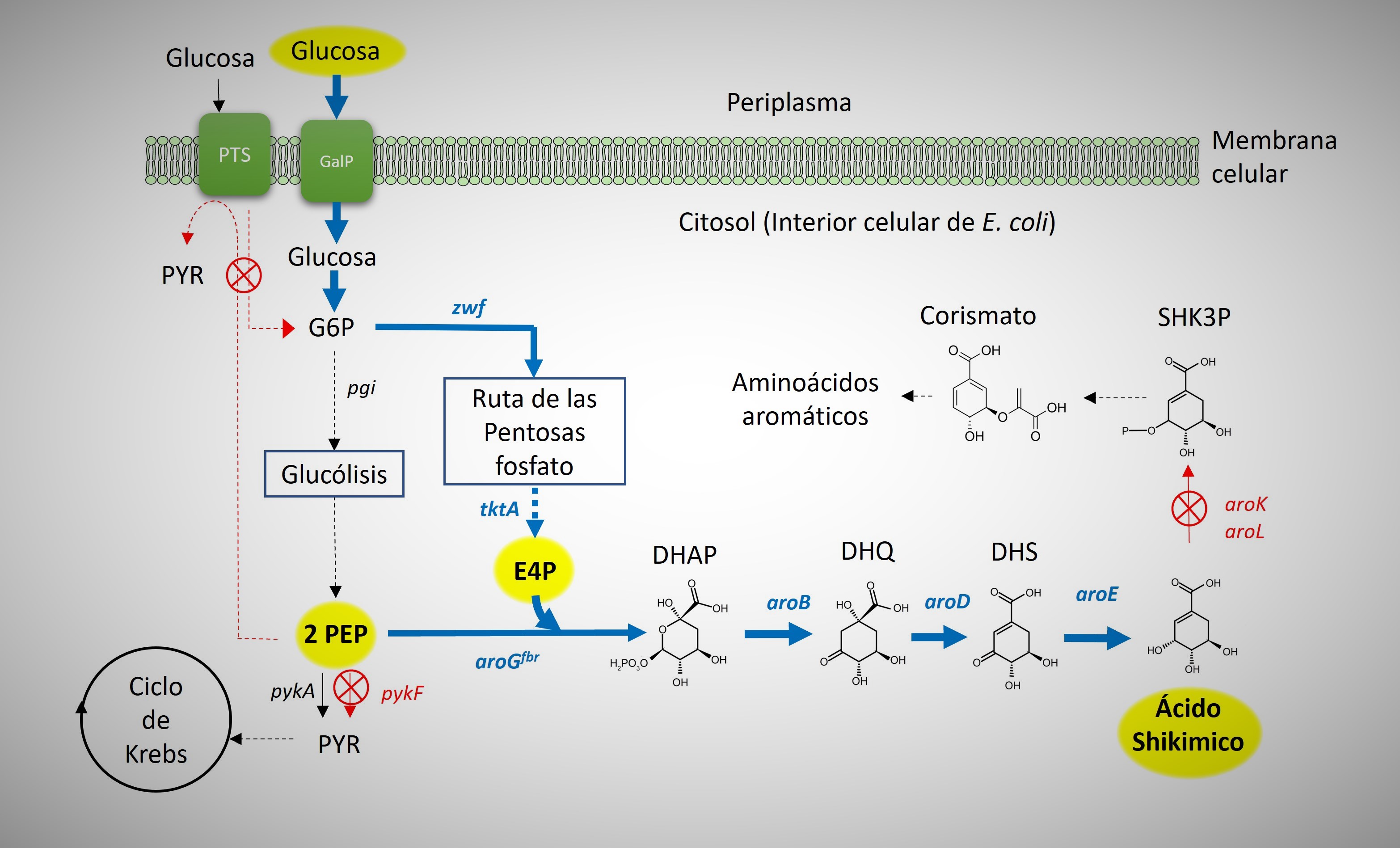
Figura 3. Esquema simplificado del metabolismo de la cepa AR36 productora de ácido shikímico (SHK). La estrategia consistió en realizar modificaciones genéticas para aumentar la disponibilidad de precursores bioquímicos como la E4P y el PEP, para canalizarlos hacia la ruta del SHK. Los nombres de genes de las enzimas sobre-expresadas se muestran en azul; los indicados en rojo fueron inactivados con técnicas de Ingeniería Genética y las líneas punteadas representan múltiples reacciones enzimáticas. Abreviaturas: G6P: glucosa-6-fosfato; PEP: fosfo·enol·piruvato; PYR: piruvato; E4P: eritrosa-4-fosfato; DHQ: des·hidro·quinato; DHQ: des·hidro·shikimato; SHK3: shikimato-3-fosfato; DHAP: 3-deoxi-D-arabino·heptulo·sonato-7-fosfato.
Entonces, para obtener una una E. coli que utilice las dos moléculas de PEP para la síntesis de SHK, pero que mejore su capacidad de crecimiento, esta cepa fue sometida a un proceso de ALE bajo condiciones de 'cultivo continuo' conocido como quimiostato, donde el flujo del medio de cultivo se ingresa y sale del biorreactor a volumen constante. Después de varias horas, la 'presión' de este sistema sobre la población de células en cultivo, selecciona favorablemente a mutantes que recuperan tasas de división y/o crecimiento más altas; es decir, los microorganismos que han crecido lentamente han sido expulsadas del biorreactor antes de dividirse mientras que las que crecen más rápido prevalecen dentro. De este modo, se aisló una mutante llamada PB12 que recuperó parcialmente su capacidad de consumo de glucosa y de crecimiento. Los estudios que realizamos sobre los genes expresados nos indicaron que esta cepa variante inicia el consumo de Glu con otro sistema transportador conocido como GalP en sustitución al PTS [Fig. 3].
Además, se realizaron modificaciones genéticas adicionales para enriquecer la disponibilidad de otros precursores como la eritrosa-4-fosfato (E4P) y el PEP, que le brindan capacidad a la cepa PB12 de canalizarlos a la vía de síntesis del SHK, en paralelo a la optimización de las condiciones de cultivo. De esta forma se obtuvo la cepa AR36, la cual demostró tener títulos de SHK de hasta 43 gramos por litro (gr/Lt) en cultivos a escala laboratorio; su rendimiento ha sido de 42 gr de SHK por cada 100 de Glu [Fig. 3]. Finalmente, bajo otras condiciones de cultivo llamadas de 'lote alimentado' (batch-fed), se obtuvieron hasta 60 gr SHK por litro, con una productividad de 2.45 gr/hr·Lt, siendo la segunda cepa de E. coli con el mayor nivel de producción de SHK reportada en la literatura científica [4]. Este resultado es una de nuestras principales contribuciones académicas, ya que aparte de estimular la innovación tecnológica con el proyecto, este conocimiento que también ha sido aprovechado globalmente por diversos grupos de investigación y desarrollo para la obtención de cepas productoras de compuestos aromáticos [4].
Nuevos compuestos y retos
En nuestro grupo de trabajo se continúa trabajando en el desarrollo de biofábricas productoras de SHK y otros compuestos aromáticos como las fenazinas, que tienen propiedades de antibióticos y antioxidantes, y en la biosíntesis de ácido amino·shikímico, un análogo del SHK que permite obtener al Tamiflu® en un menor número de pasos [3]. También se continúan estudiando otros los cambios genómicos, fisiológicos y metabólicos que ocurren durante la ALE de las cepas que se afectaron en el sistema PTS.
Referencias
-
Jens Nielsen & Jay D. Keasling (2016). Engineering Cellular Metabolism. Cell. 164(6): 1185-1197. DOI: 10.1016/j.cell.2016.02.004
-
Sang Yup Lee (2016) Systems Metabolic Engineering Turns Microbes into Factories. Sci Amer. Disponible en https://www.scientificamerican.com/ article/systems -metabolic-engineering-turns-microbes-into-factories/
Adelfo Escalante, Rubén Mendoza-Flores, Guillermo Gosset, Francisco Bolívar (2016). The aminoshikimic acid pathway in bacteria as source of precursors for the synthesis of antibacterial and antiviral compounds, J Indust Microbiol Biotech 48: (9-10) DOI: 10.1093/jimb/kuab053
Martínez J, Rodriguez A, Moreno F, et al. (2018). Metabolic modeling and response surface analysis of an Escherichia coli strain engineered for shikimic acid production. BMC Syst Biol 12 (102). DOI: 10.1186/s12918-018-0632-4
Comparte este artículo en redes sociales

Acerca de los autores
Rubén Mendoza Flores es Maestro en Ciencias Bioquímicas, egresado del Instituto de Biotecnología-UNAM; Los Dres. F. Bolívar y A. Escalante, son investigadores titulares del Departamento de Ingeniería Celular y Biocatálisis del IBt-UNAM, ubicados en Cuernavaca, Morelos, México
Contacto: adelfo.escalante@ibt.unam.mx; ruben.mendoza@ibt.unam.mx




