Peripecias de viaje hacia una vacuna contra la anaplasmosis bovina
Elizabeth Salinas Estrella, Mayra Elizeth Cobaxin Cárdenas y Sergio D. Rodríguez Camarillo
Tal como el emblemático personaje de Verne, el profesor de mineralogía Otto Lidenbrock, “…que encontró en Islandia el lugar para entrar al centro de la Tierra” [1], Sir Arnold Theiler, descubrió en Sudáfrica a principios del siglo XX, un patógeno que ocasionaba cierta enfermedad en los bovinos y además, propuso una forma de proteger a los animales contra esa enfermedad [2]; en comparación, se puede decir que también abrió una ruta de las ciencias veterinarias, una entrada “al centro de la Tierra” respecto de esa y otras enfermedades, al identificar al causante microbiano y desarrollar una propuesta de protección contra la anaplasmosis bovina.
Anaplasma marginale, es el género y especie de las bacterias que, identificadas desde 1909, infectan a los bovinos y originan la anaplasmosis bovina que para muchos animales es mortal. Poco tiempo después se identificó Anaplasma centrale y, al observar que la gravedad de los signos que ocasionaba era menor que los de la primera especie bacteriana (fiebre, anemia, anorexia), comenzó a proponerla como vacuna viva para la anaplasmosis bovina [3]. Sin embargo, han pasado muchos años que no han estado exentos de obstáculos en este viaje hacia La vacuna: una inmunización que sea altamente eficiente, de única aplicación y universal: algo parecido a los tesoros del “centro de la Tierra”.
Anaplasma marginale ocasiona una enfermedad severa en bovinos adultos al primer contacto con la bacteria. Los más susceptibles son principalmente, vacas o toros mayores a un año, provenientes de zonas libres de anaplasmosis que —con el objetivo de mejorar la producción de carne o de carne y leche en ganado vacuno— son movilizados a regiones con presencia de la enfermedad (zonas enzoóticas), donde hay prevalencia de vectores como garrapatas, moscas, tábanos, así como de malas prácticas del manejo humano, que pueden provocar el padecimiento (iatrogenia). Esto es un problema severo ya que globalmente, no existe una vacuna comercial contra la anaplasmosis bovina. Anaplasma centrale sigue usándose actualmente en varios países como recurso vacunal contra la anaplasmosis. En México, sin embargo, ésta no puede ser usada puesto que el agente causal, es un organismo exótico en el país; es decir, que no se ha detectado su presencia de forma usual o extendida en los hatos bovinos [4,5].
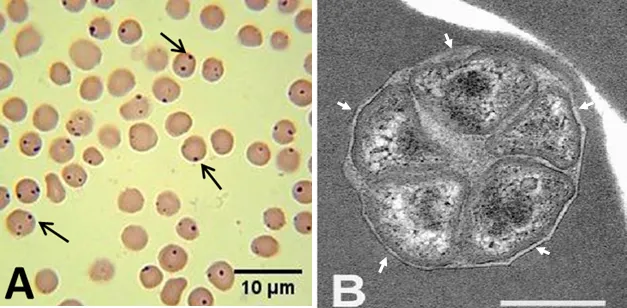
Figura 1.

Figura 2.
¿Dónde y cómo se presenta la anaplasmosis?
Las regiones tropicales o subtropicales de México (costa del Golfo, estados de Veracruz, Tabasco; Chiapas) son ricas en recursos naturales y, además, presentan una temperatura cálida sin muchas variaciones durante el año, que son favorables para la producción de bovinos de carne. Allí también ocurre la presencia de garrapatas de diversos géneros, entre las que destacan los géneros Rhipicephalus y Dermacentor, que son transmisoras biológicas de Anaplasma; esto significa que las bacterias pueden infectar las células de las glándulas salivales, intestinales y ováricas de las garrapatas, de estas últimas se originarán larvas de garrapata capaces de infectar a otros bovinos. Además, las condiciones climáticas de estas regiones promueven también la presencia de moscas y tábanos en las ganaderías, los cuales son transmisores mecánicos, es decir, llevan externamente al agente causal de un bovino a otro, lo que es suficiente para producir brotes en ganaderías libres de anaplasmosis, cercanas a aquellas infectadas con Anaplasma. Esto ocurre sin considerar que, de forma similar a otras enfermedades, los humanos participamos frecuentemente en la dispersión de la enfermedad entre los animales de un hato; una actividad común es utilizar material de inmunización (una misma aguja entre uno y otro bovino); se ha demostrado que esta práctica puede transmitir sangre infectada hasta en seis animales en los que se haya compartido material contaminado [5,6].

Figura 3.
Debido a que la producción de bovinos es una de las actividades agropecuarias más importantes de nuestro país (en 2019 México fue el sexto productor de carne de res, con 2’027,634 toneladas de carne, lo que representa un valor de 139,612 millones de pesos; mientras que se reportaron 2 millones 564 mil cabezas de ganado bovino productoras de leche), durante el transcurso de los años se han realizado diversos esfuerzos para encontrar un candidato vacunal ideal contra la anaplasmosis bovina. Sin embargo, conforme la tecnología ha ido avanzando —tal como en la trama verniana, cuando Lidenbrock y su sobrino Axel iban internándose por las desconocidas cavernas del Sneffels— fue posible dilucidar más sobre la composición y comportamiento de esta bacteria patógena, que aún hoy plantea varias paradojas a expertos y legos [8,9]. Las bacterias del género Anaplasma son microorganismos pequeños, de 0.3 a 0.8 µm de diámetro y con un genoma de poco más de 1 millón de pares de bases (1 Mpb); no obstante, la diversidad de las secuencias genéticas encontradas, y la variabilidad antigénica de las proteínas susceptibles de ser reconocidas por anticuerpos, es sorprendente. Esto explica que a pesar de tantos años y recursos invertidos en la búsqueda de una vacuna, no se ha logrado generar un inmunógeno efectivo a nivel global; incluso se llegó a decir que ni siquiera se desarrollaría una efectiva a nivel nacional o regional.
Proteínas externas de Anaplasma y vacunas neutralizantes
La comunidad de investigación veterinaria alrededor del mundo ha ido ensayando diferentes proteínas de membrana de A. marginale como inmunógenos (que potencialmente ‘levanten’ una respuesta inmune). Con varias de ellas se lograba generar anticuerpos en los animales inmunizados, pero no adecuados para observar un efecto neutralizante o protector, al desafiar con otras cepas de dichas bacterias. Se propuso entonces buscar y utilizar aquellas proteínas que compartieran sitios de reconocimiento por anticuerpos (epítopos, que son regiones moleculares externas, con formas características), presentes en distintas cepas, para poder ser inoculadas en animales de diferentes locaciones. A pesar de haber encontrado que algunas de ellas sí compartían ciertos epítopos, los ensayos de inmunización en animales carecieron de efectividad. Esto se explica por la variación y recombinación genética de los genes correspondientes, que generaban proteínas variantes que ya no eran reconocidas por los anticuerpos obtenidos anteriormente.
En México, se realizaron varios estudios similares y se encontraron diferentes cepas de Anaplasma marginale infectando un mismo hato e incluso, un mismo animal. A continuación, en el INIFAP se desarrolló la primera vacuna “regional” contra la anaplasmosis bovina, la cual requiere la combinación de tres cepas diferentes, dos de las cuales deben ser originarias de la zona donde se realizará la inmunización [10]. Con esta estrategia se logró la protección de bovinos en zonas de elevada producción ganadera con brotes de anaplasmosis; los animales quedaron protegidos al desafío de las cepas con las cuales se habían inmunizado (cepas homólogas), y también, de cepas que compartieran algunos epítopos. Sin embargo, la protección disminuyó predecible-mente al desafiar con cepas diferentes (heterólogas) que no tuvieran similitud en los epítopos de las moléculas expuestas en la membrana del patógeno.
Años después, en nuestros laboratorios se encontró una cepa nacional que, usada como inmunógeno, lograba la protección de bovinos al desafío con cepas diferentes [11]. Las colecciones de cepas microbianas (ceparios), conservan muestras viables de microbios aislados para diversas pruebas y producción. Esta cepa (MEX-31-096-01, disponible en el INIFAP) ha sido usada con éxito en diversos hatos ganaderos de regiones tropicales y subtropicales donde han ocurrido brotes de anaplasmosis. Su uso como vacuna, se recomienda principalmente para bovinos jóvenes de 6 hasta 10 meses de edad (aunque se han vacunado animales de todas las edades con resultados satisfactorios), y en aquellos que serán movilizados de una zona libre de anaplasmosis a una zona enzoótica. Si bien se cuenta con la tecnología y el servicio de inmunización, la producción y preparación de la vacuna, requiere de una inversión a corto plazo que retribuye —a lo largo de las cadenas productivas— en ahorros económicos signifi-cativos, al disminuir los gastos en consultas y tratamientos; evitando decrementos en la producción de carne y/o leche, pero sobre todo, evitando la muerte de bovinos, algunos de los cuales tienen un valor económico muy alto, debido justamente a la inversión en el mejoramiento genético realizado en los hatos ganaderos [9].
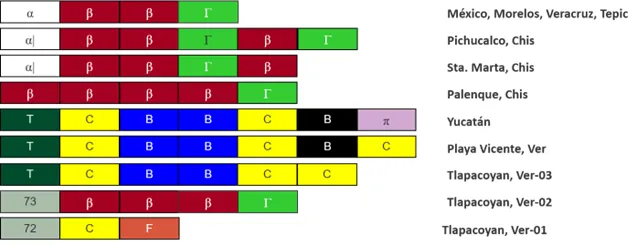
Figura 4.
La aventura de la investigación en sanidad animal
Con todo lo relatado, y siguiendo nuestra historia paralela, el “viaje al centro de la tierra” equivalente, no termina ahí en la investigación y control de la anaplasmosis. A diferencia de Lidenbrock, —quien viajó sin un mapa de las entrañas de la Tierra guiado al inicio más que por el pergamino y las marcas (A.S.), de Arne Saknussemm— para los investigadores en anaplasmosis la obtención o captura, resguardo y mantenimiento de cepas de Anaplasma, ha motivado internarse en las técnicas de secuenciación genómica de algunas de ellas (lo que sería análogo a disponer de mapas, rutas y a toda una cartografía). Al obtener, analizar y comparar las secuencias genéticas y proteicas de este grupo, se facilita elaborar otro tipo de vacunas diseñadas para presentar los eptítopos más reactivos; unas derivadas de proteínas recombinantes producidas en biorreactores, así como las formuladas a base de péptidos sintetizados en laboratorio. Ambas pueden ser utilizadas de forma segura en bovinos de todas las edades, con pocos requerimientos de manejo y que sean protectoras contra todas las cepas de origen nacional e, idealmente, contra cepas de otros países.
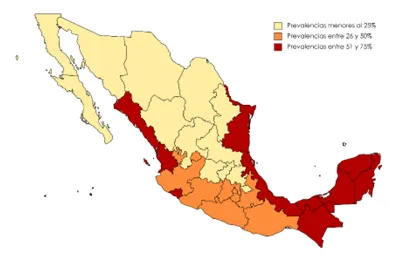
Figura 5.
Así pues, nos encontramos aún ante un gran desafío inmunológico y, tal como en los océanos subterráneos de Julio Verne, el horizonte parece cercano, pero es vasto. Las aguas que parecen ser tranquilas a partir de ahora pueden amenazar con alguna tormenta imprevista que pueda hacernos desandar el camino, sin embargo, el esfuerzo y la intención por realizar ese viaje continúa con renovados bríos, con tal de llegar a conocer y desentrañar un mundo interior, como el “centro de la Tierra”: esa vacuna tan ansiada y necesaria para mejorar la salud del ganado bovino en nuestro país.
Referencias
1. Verne J. (1864). Viaje al Centro de la Tierra. Dominio público.
2. Palmer GH (2009). Sir Arnold Theiler and the discovery of anaplasmosis: A centennial perspective. Onderstepoort J Veterin Res. 76: 75–79.
3. Theiler, A (1911). Further investigations into anaplasmosis of South African cattle. Pretoria: Government Printer and Stationery Office.
4. Almazan C, Tipacamu GA, Rodriguez S, Mosqueda J, de Leon AP (2018). Immunological control of ticks and tick-borne diseases that impact cattle health and production. Front Biosci-Landmark *23 (8), 1535-1551. DOI: 10.2741/4659.
5. Preciado de la Torre JF, I Amaro-Estrada, E Salinas-Estrella, MA García-Ortega, SD Rodríguez-Camarillo (2020). ¿Cómo se infectan de Anaplasmosis los bovinos? Entorno Ganadero. año 17, núm. 102: 66-72, ISSN: 2395-9592.
6. Salinas-Estrella E, Cobaxin-Cárdenas ME, Preciado de la Torre JF, Rodríguez-Camarillo SD (2021). ¿Cómo diagnosticar la anaplasmosis bovina? Entorno Ganadero. año 17, núm. 105: 46-50. ISSN: 2395-9592.
7. Servicio de Información Agroalimentaria y Pesquera. 2020. Panorama Agroalimentario-2020. Secretaría de Agricultura y Desarrollo Rural. https://nube.siap.gob.mx/gobmxpublicacionessiap/pag/2020/Atlas-Agroalimentario-2020. Consultado el 15/08/2022.
8. Martínez-Ocampo F, Quiroz-Castañeda RE, Amaro-Estrada I, Dantán-González E, de la Torre JFP, Rodríguez-Camarillo S (2020). Whole-genome sequencing of mexican strains of Anaplasma marginale: an approach to the causal agent of bovine anaplasmosis. Intern J Genomics 5902029. DOI: 10.1155/2020/5902029*.
9. Salinas-Estrella E, ME Cobaxin-Cárdenas, I Amaro-Estrada, Preciado de la Torre JF, SD Rodríguez-Camarillo (2022). ¿Cómo curar a los bovinos enfermos de anaplasmosis? Cebú Mexicano, año 10, núm. 61: 17-23.
10. Camarillo SDR, Ortiz MÁG, Alarcón GJC, Salgado GH, Cerda NS, Torres RA (1999). Ensayo de un inmunógeno experimental inactivado contra Anaplasma marginale. Rev Mex Ciencias Pecuarias 37(1), 1-12.
11. Camarillo SDR, Ortiz MÁG, Ramírez EER, Alarcon GJC, De La Torre JFP, Cruz RR, Torres RA (2008). Anaplasma marginale Yucatan (Mexico) strain: assessment of low virulence and potential use as a live vaccine. Ann NY Acad Sci 1149(1), 98-102.
12. Rodríguez SD, García-Ortiz MA, Jiménez-Ocampo R, Vega y Murguía CA. Molecular epidemiology of bovine anaplasmosis with a particular focus in Mexico. Infect Genet Evol 9:1092–1101.
Comparte este artículo en redes sociales

Acerca de los autores
La M. en C. Elizabeth Salinas Estrella, la Dra. Mayra Elizeth Cobaxin Cárdenas y el Dr. Sergio D. Rodríguez Camarillo, son investigador@s del Centro Nacional de Investigación Disciplinaria en Salud Animal e Inocuidad (CENID-SAI) del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), sito en Jiutepec, Mor.
Contacto: mvz.elisalinest@gmail.com, mayracobaxin@gmail.com, sergeiyevsky@gmail.com



